LA LA TRANSFORMACIÓN DE LOS MATERIALES: LA REACCIÓN QUÍMICA
INTRODUCCIÓN
En este bloque se aborda la identificación del cambio químico y
se orienta al tratamiento de reacciones químicas sencillas que ocurren en
fenómenos cotidianos utilizando, entre otras habilidades, la interpretación y
representación. Asimismo, se destaca que en una reacción química se absorbe y
desprende calor; este tema se vincula con el aporte calórico de los alimentos,
para que se favorezca la toma de decisiones informadas relacionadas con la importancia
de mantener una alimentación correcta.
La tercera revolución de la química destaca la importancia de
los trabajos de Gilbert N. Lewis, al proponer que en el enlace químico los
átomos adquieren una estructura estable en la formación de compuestos, y de
Linus Pauling, al identificar el tipo de enlace (covalente o iónico) por medio
de la tabla de electronegatividad.
Respecto a los compuestos químicos, se puntualiza que su
transformación se lleva a cabo en una enorme cantidad de átomos susceptibles de
ser contabilizados con una unidad de medida.
Los proyectos sugieren el fortalecimiento de habilidades, como
el planteamiento de preguntas, predicciones y explicaciones cercanas al
conocimiento científico; la búsqueda de evidencias; la identificación de
variables; la interpretación de experimentos; el análisis de resultados a
partir de la elaboración de jabones, y la obtención de energía en el cuerpo
humano.
OBJETIVOS
- Identifiquen en su entorno algunas reacciones químicas sencillas, sus principales características y sus representaciones.
- Expliquen enunciados científicos, como el principio de conservación de la masa, a partir de los conocimientos adquiridos a lo largo del curso.
- Integren habilidades, actitudes y valores durante el desarrollo de proyectos enfatizando la interpretación y aplicación del uso de escalas en forma adecuada a diferentes niveles (macroscópico y microscópico).
- Reconozcan que las moléculas presentan arreglos definidos que son los que determinan las propiedades de los materiales y que su transformación no se lleva a cabo en una molécula aislada, sino en una enorme cantidad de ellas que se contabilizan con el mol como unidad de medida.
- Identifica algunos cambios químicos que ocurren en su entorno.
- Identifica reactivos y productos que participan en un cambio químico y diferencia sus propiedades.
- Construye modelos de compuestos con base en la representación de Lewis.
- Modela en forma tridimensional algunos compuestos para identificar los enlaces químicos y con ellos explicar cómo se forman los nuevos en algunas reacciones químicas sencillas.
- Relaciona el modelo tridimensional de compuestos con su fórmula química y su valencia.
- Representa el cambio químico mediante una ecuación e identifica la información que contiene.
- Verifica la correcta expresión de la ecuación química utilizando el principio de conservación de la masa y la valencia.
- Predice la formación de moléculas utilizando el modelo de valencia
REACCIÓN QUÍMICA
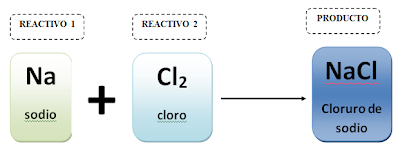
- Una reacción química es todo proceso en el cual dos o más sustancias llamadas reactivos, por efecto de un factor energético se transforma en otras sustancias llamadas productos
- Una sustancia puede ser un elemento o un compuesto
- A la representación simbólica de una reacción química se le llama ecuación química
Existen
dos grandes modelos de reacciones químicas
A) Acido-base (sin cambios de estado de agregación)
B)
Reacciones REDOX
( con cambios en los estados de agregación)
LA PRIMERA
REVOLUCIÓN DE LA QUÍMICA: EL PRINCIPIO DE CONSERVACIÓN DE LA MASA
LA IMPORTANCIA DE LAS APORTACIONES DEL
TRABAJO DE LAVOISIER
2.4 LA DIVERSIDAD DE LAS SUSTANCIAS
TEMA 2. MEZCLAS, COMPUESTOS Y ELEMENTOS
Se llama sustancia pura a aquella que no se puede descomponer en otras mediante procedimientos físicos (como calentamiento o un campo magnético). Es posible que la sustancia pura se descomponga mediante reacciones químicas; si se descompone en más de un elemento químico, se dice que la sustancia es compuesta; en caso contrario, se dice que es una sustancia simple.
Se llama mezcla al resultado de la combinación de varias sustancias puras, y es posible la separación de éstas mediante procedimientos físicos (destilación, evaporación, suspensión y filtración) y mecánicos (decantación e imantación).
Se dice mezcla homogénea a aquella en la que las propiedades intensivas son las mismas en toda la mezcla (por ejemplo, sal disuelta en agua). Estas propiedas intensivas son las que no dependen de la cantidad de material considerado (por ejemplo, densidad, sabor, viscosidad, calor específico).
Existe un método, que se apoya en el efecto Tyndall, que permite determinar con facilidad si se trata de una mezcla homogénea. Para que una mezcla se pueda considerar homogénea no se deben poder observar partículas en suspensión al iluminar la mezcla mientras se observa en dirección perpendicular a la del haz de luz.
Se dice mezcla heterogénea a aquella en la que las partes mantienen propiedades intensivas diferentes (por ejemplo, arena mezclada con serrín).
TEMA
3.¿CÓMO ES LA ESTRUCTURA DE LOS MATERIALES?
• EL MODELO ATÓMICO
JON DALTON
(1766-1844)
- Físico y quimio ingles que sentó las bases de la estructura de la materia el cual diseño el primer modelo atómico, la teoría atómica la estableció el 21 de octubre de 1803
- En 1808 propuso su modelo atómico diciendo que los átomos son pequeñísimas esferas solidas compactas que se unen para formar compuestos (como una pelota)
- La separación y unión de átomos se realizaban en reacciones químicas
- Su modelo no lograba explicar el comportamiento de la materia, y además no fue cuestionado por décadas
- Su modelo atómico de Dalton se caracterizaba por su masa
Postulados de Dalton.
Dalton explicó su teoría formulando una serie de
enunciados simples:1
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su
propio peso y cualidades propias. Los átomos de los diferentes elementos
tienen pesos diferentes.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones
químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en
proporciones distintas y formar más de un compuesto.
Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
JOSEPH JOHN "J.J." THOMSON
(1856-1940)
- Físico ingles que propuso su modelo atómico de Thomson, es una teoría sobre la estructura atómica propuesta en 1904
- Descubrió el electrón[1] en 1897, mucho antes del descubrimiento del protón y del neutró
- Descubre el átomo con una esfera electrificada positivamente dentro del cual se mueven los electrones
- Su modelo se comparo como un pastel de pasas en el cual estas eran los electrones con carga negativa y budín (pastel) con carga positivo
- El nuevo modelo atómico usó la amplia evidencia obtenida del estudio de los rayos catódicos
- La carga total del átomo se decía que es neutra
- 1906 Thomson fue premiado con el novel de física por este descubrimiento.
ERNEST RUTHERFORD
(1871-1937)
- Propuesto por el químico y físico británico Ernest Rutherford
- En 1911 propuso su modelo atómico con un núcleo donde se centra la carga positiva y alrededor del núcleo giran los electrones con carga negativa
- El modelo fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
- Proponer por primera vez la existencia de un núcleo en el átomo
- Según Rutherford, las órbitas de los electrones no están muy bien definidas
- Sugirió el nombre de protón para la participación con carga positiva
- Comparaba su modelo atómico con el sistema solar
NIELS BORH
(1885-1962)
- Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo
- En 1922 recibió el premio nobel por haber perfeccionado el modelo atómico de rutherford con la “teoría de los cuantos” se basó en el átomo de hidrógeno para hacer el modelo que lleva su nombre
- su modelo atómico de orbitas circulares, características definidas donde giran los electrones
- un núcleo donde giran los protones (+) y neutrones (+)
- james Chadwike en 1932 descubrió los neutrones con carga neutra
- capacidad electrónica de cada nivel se le conoce como ley de ridberg
- el número máximo de electrones admitidos en los niveles de energía es igual al duplo de los cuadrados de los números naturales.
- n2 = nivel de energía
- 2 x n2 = numero de electrones
- 2 x (1)2 = 2 electrones2 x (2)2 = 8 electrones2 x (3)2 = 18 electrones2 x (4)2 = 32 electrones2 x (5)2 = 50 electrones
2 x (6)2 = 72 electrones2 x (7)2 = 98 electrones
Arnold Sommerfeld
(1868-1951)
- Físico alemán que modificó el modelo atómico de Bohr, en el cual estableció en 1916, en su modelo propuso ondas elípticas en cual giran los electrones.
- donde además de niveles aparecen subniveles s, p, d, f, originando a la configuración cuántica
- propone una ecuación matemática que da a el electrón el carácter de onda
- actualiza nuevamente el modelo de átomo que en la actualidad se emplean cálculos pirobalísticas para descubrir la posición , velocidad y energía de los electrones del átomo
- ACTIVIDAD.- realiza las siguientes configuraciones en tu libreta
- ÁTOMO
El átomo es un constituyente de la materia
ordinaria, con propiedades químicas bien definidas, formado a su vez por
constituyentes más elementales sin propiedades químicas bien definidas. Cada elemento químico está formado por átomos del
mismo tipo (con la misma estructura electrónica básica), y que no es posible
dividir mediante procesos químicos.
Actualmente se conoce que el
átomo está compuesto por un núcleo atómico, en el que se concentra casi
toda su masa, rodeado de una nube de electrones. Esto fue descubierto a
principios del siglo XX, ya que durante el siglo XIX se había pensado que los
átomos eran indivisibles, de ahí su nombre a-tómo- 'sin división'. Poco después se descubrió que también el
núcleo está formado por partes, como los protones,
con carga positiva, y neutrones,
eléctricamente neutros.
Los electrones, cargados negativamente, permanecen ligados a este
mediante la fuerza electromagnética.
Los átomos se clasifican de
acuerdo al número de protones y neutrones que contenga su núcleo. El número de
protones o número atómico determina su elemento químico, y el número de neutrones
determina su isótopo. Un átomo con el mismo número de protones que de
electrones es eléctricamente neutro. Si por el contrario posee un exceso de
protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
LEYES PONDERALES
ACTIVIDAD.- realizar una investigación sobre la configuraciones electrónicas de niels Borh
ACTIVIDAD.- REALIZAR LAS SIGUIENTES
CONFIGURACIONES ELECTRÓNICAS:
3º C
Ga, Ge, Sb, Te, Bi Ca, Rb, Cs, Kr, Bi
3º D
Mg, Ca, B,
C, P, Si As, Sn, Ag, Hg, Cl, At, In, Cu
3º F
Mg, Li, Sr, Al, O, F, As, Te, I, Po
ACTIVIDAD.- OBTÉN LOS DATOS QUE
SE TE PIDEN DE LOS SIGUIENTES ELEMENTOS:
Br, Mg, Be, Sr, P, O, Al, Na, Ar, C, Fe, Au, Cr
PARTÍCULAS DEL ÁTOMO.
ELECTRONES INTERNOS Y EXTERNOS.
Tras las aportaciones de Niels Bohr y muchos otros
investigadores, el modelo atómico que manejamos quedo formado por el núcleo
positivo con protones y neutrones, mientras que los electrones se mueven a su
alrededor repartidos en distintas orbitas o capas.
En cada orbita o capa cabe un determinado número máximo
de electrones
ELECTRONES INTERNOS
En cada átomo, los electrones ocupan primero las orbitas
más cercanas al núcleo, que son las de menor energía y cuando las van
completando empiezan a llenar la siguiente.
Las capas que se van llenando quedan “ESTABLES”, ya no se
modifican y resulta difícil cambiar los electrones
ELECTONES EXTERNOS
El atomo solo es estable químicamente cuando todas las
capas en las que hay electrones están llenas.
Si en la última capa llamada “CAPA DE VALENCIA”, el
numero de electrones no es el máximo posible, ese elemento será inestable y
reaccionara con otros átomos, compartiendo o intercambiando electrones la cao
amas externa quede completa
Los electrones de la ultima capa u orbita se llaman
“ELECTRONES DE VALENCIA”
MODELO DE LEWIS Y ELECTRONES DE VALENCIA
Gilbert N. Lewis (1875-1946) químico estadounidense que
invento un método ingenioso para explicar la unión de los elementos químicos
para formar compuestos
En 1923 presento su libro “la valencia y la estructura de
los átomos y las moléculas
Fue uno de los primeros Químicos que considero la
importancia que tenía el modelo de Bohr para explicar la formación de
compuestos
Fue él quien llamo electrones de “valencia” a los electrones
externos, ya que la valencia era el termino para describir cuantos enlaces
formaban determinados elementos
El modelo que lleva su nombre, no es un modelo atómico,
sino una forma de representación que se centra en los electrones que se
encuentran en la capa de valencia
Para representar el elemento solo se escribe su símbolo y
se rodea de puntos o marcas que corresponden solo a los electrones de valencia
ejemplo:
REGLA DEL OCTETO.
·
Lewis observo la distribución de electrones
externos alrededor del núcleo y pudo darse cuenta de la estabilidad de un
elemento cuando tiene 8 electrones en su última orbita del modelo, y ahí
propuso una regla muy útil en química, la regla del octeto.
·
“ una estructura molecular o de red es mucho más
estable cuando cada átomo contiene un octeto de electrones en la capa de
valencia”
·
Cuando se pierden o ganan electrones, los átomos
dejan de ser neutros pues quedan con las cargas desequilibradas
o
Cuando un átomo (metal) pierde un electrón y
queda con una carga positiva, es decir forma un Ion positivo o Catión.
+
Na
o
Cuando un átomo (no metal) gana un electrón
queda con una carga negativa y forma un Ion negativo o anión
-
Cl
o
Las partículas de carga opuesta se atraen, es decir
se neutralizan
ACTIVIDAD.- realizar las representación
de los siguientes elementos son el modelo de Lewis ejemplo:
17 Li,
Be, B, C, Ge, Se, Cl, In, F, As, Kr, I, Ca, K, P, O
ACTIVIDAD.- Recuerda y reflexiona
acerca de los elemento s de la tabla periódica y en base a tus conocimientos
coloca el nombre o símbolo según corresponda.
ACTIVIDAD.- Razona y coloca los electrones, protones y
neutrones de cada uno de los siguientes elementos de acuerdo a tus
conocimientos.
IACTIVIDAD: Lee
con mucha atención cada una de las oraciones y coloca en tu hoja de respuestas Falso
o Verdadero según tu criterio.
1.- ________
El átomo de descubrió en Grecia
2.- ________ En una molécula sus átomos son
iguales y se representa por medio de símbolos
3.- ________ Los átomos se representan por medio
de formulas
4.- ________ Lavoisier sentó las bases de la
teoría de la estructura de la materia
5.- ________ John Dalton propuso su modelo
atómico diciendo que los átomos como pequeñas esferas solidas compactas, como
una pelota
6.- ________ John Joseph Thompson se le atribuye
el descubrimiento del electrón
7.- ________ Rutherford decía que su modelos era
como una esfera electrificada positivamente comparándola con un pastel de pasas
8.- ________ Rutherford se le atribuye el nombre
de protón
9.- ________ Dalton propuso su modelo con un
núcleo conde la carga es positiva y alrededor del núcleo giran los electrones
comparaba su modelo con el sistema solar
10.-
________ Sounmerfeld en su modelo propuso orbitas elípticas en las cuales giran
los electrones
11.-
________ Niels Borh propuso en su modelo atómico orbitas circulares donde giran
los electrones y un núcleo donde se localizan los protones y neutrones
12.-
________ Dalton y Thompson descubrieron el Neutrón
13.-
________ Un átomo es neutro porque tienes mismas cargas positivas y neutras
14.-
________ Los átomos de un elemento son iguales entre si
15.-
________ En una átomo las sub partículas
protones y neutrones se localizan el núcleo y los electrones en girando
en las orbitas

















No hay comentarios:
Publicar un comentario